Classement de sécurité du logiciel
(de) dispositif médical
Maurice Navarro
Consultant qualité & logiciel pour dispositifs médicaux
Depuis plusieurs années, les anomalies du logiciel sont la principale cause de rappel de dispositifs médicaux.
Les rappels de dispositifs médicaux ont lieu quand une caractéristique ou un dysfonctionnement du dispositif génère des risques inacceptables pour les personnes ou l'environnement.
Pour les prévenir il faut réduire la probabilité des anomalies dangereuses du logiciel. C'est l'objectif du classement de sécurité des logiciels (de) dispositifs médicaux.
Par contre, ce classement ne garantit pas la fiabilité globale du logiciel.
Traitons cette question à l'occasion de cet article.

Qu'est-ce que le classement de sécurité du logiciel (de) dispositif médical ?
Le classement de sécurité des logiciels (de) dispositifs médicaux est défini par la norme CEI EN 62304 (Logiciels de dispositifs médicaux - Processus du cycle de vie du logiciel). Il s'agit d'une norme harmonisée par l'Union Européenne pour la mise en œuvre de la réglementation relative aux dispositifs médicaux.
Ce classement détermine
les types de documents techniques qu'il faudra générer et
les étapes de conception et développement que le logiciel (de) dispositif médical devra suivre
pour assurer sa conformité aux exigences applicables.
A ce jour, les règles de classification de sécurité définissent trois classes de logiciels en fonction de la gravité des conséquences possibles de leurs éventuelles anomalies.
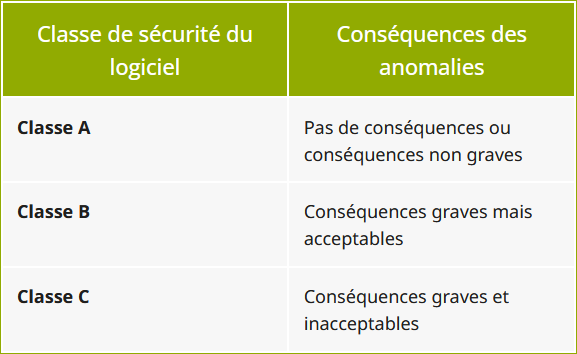
| Classe de sécurité du logiciel | Conséquences des anomalies |
|---|---|
| Classe A | Pas de conséquences ou conséquences non graves |
| Classe B | Conséquences graves mais acceptables |
| Classe C | Conséquences graves et inacceptables |
Pour établir le classement de sécurité d'un logiciel (de) dispositif médical il faut envisager les situations possibles en cas d'anomalie du logiciel et en l'absence de toute pondération par l'utilisateur ou par d'autres intervenants.
Impact du classement de sécurité sur l'ingénierie du logiciel
La réglementation sur les dispositifs médicaux prévoit d'autant plus d'exigences pour la conception et le développement d'un logiciel (de) dispositif médical que ses anomalies potentielles sont susceptibles de porter à conséquences.
En effet, l'objectif du classement de sécurité du logiciel (de) dispositif médical est d'assurer une fiabilité du logiciel proportionnelle aux risques générés par ses anomalies éventuelles.

| Classe de sécurité du logiciel | Objectif de la réglementation |
|---|---|
| Classe A | — |
| Classe B | Que le logiciel fonctionne bien dans les cas de figure usuels |
| Classe C | Que le logiciel fonctionne bien dans tous les cas de figure |
La figure ci-dessous indique les étapes de conception et développement requises par la norme CEI EN 62304 pour chaque classe de sécurité de logiciel (de) dispositif médical.
requises par la norme CEI EN 62304
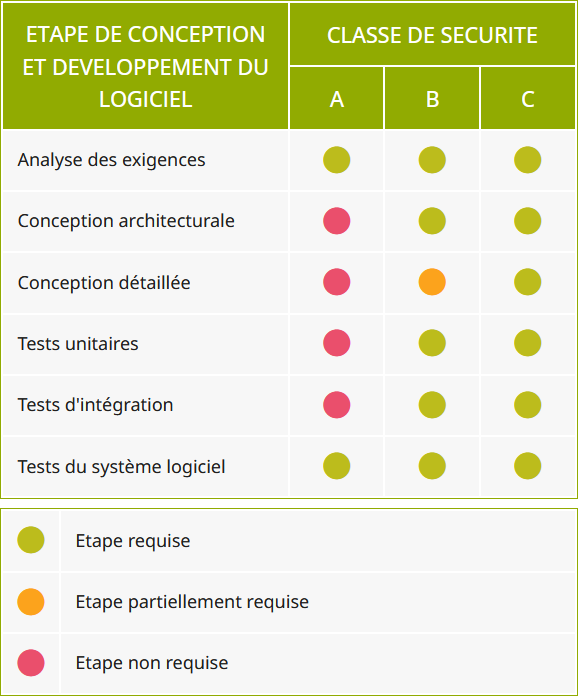
| ETAPE DE CONCEPTION ET DEVELOPPEMENT DU LOGICIEL | CLASSE DE SECURITE | ||
|---|---|---|---|
| A | B | C | |
| Analyse des exigences | |||
| Conception architecturale | |||
| Conception détaillée | |||
| Tests unitaires | |||
| Tests d'intégration | |||
| Tests du système logiciel | |||
| Etape requise | |
| Etape partiellement requise | |
| Etape non requise |
On remarque que plus le classement de sécurité d'un logiciel (de) dispositif médical est bas et moins il y a d'étapes de conception et développement pour filtrer ses possibles anomalies.
Ceci est particulièrement visible pour les logiciels de classe de sécurité A : la norme CEI EN 62304 ne prévoit aucune conception pour ces logiciels.
En effet, si les anomalies du logiciel n'impliquent aucun risque pour les personnes ou l'environnement, la réglementation sur les dispositifs médicaux ne s'en soucie pas.
Impact du classement de sécurité sur la documentation du logiciel
D'un point de vue purement réglementaire, le but de la documentation d'un logiciel (de) dispositif médical est de prouver que les exigences applicables à la conception et le développement du logiciel ont été respectées par le fabricant.
Par voie de conséquence, plus le classement de sécurité d'un logiciel (de) dispositif médical est bas et moins la réglementation exige qu'il soit documenté.
Pourtant, du point de vue de l'ingénierie, l'objectif de la documentation est de permettre la maîtrise du logiciel. En effet, la documentation du logiciel consigne les réflexions menées et les approches retenues pour assurer son fonctionnement.
La maîtrise d'un logiciel peut se mesurer avec plusieurs indicateurs :
le temps nécessaire pour mettre en œuvre des évolutions fonctionnelles ou des corrections du logiciel,
le temps requis pour que de nouveaux collaborateurs puissent efficacement prendre part à sa conception et son développement,
le nombre de dysfonctionnements connus du logiciel,
la probabilité de régression du logiciel par maintenance évolutive ou corrective…
L'expérience montre que la valeur de ces indicateurs augmente avec la diminution de la documentation du logiciel.
En effet, en l'absence d'informations écrites qui décrivent l'architecture du logiciel et les approches d'implémentation mises en œuvre, les évolutions du logiciel reposent sur les souvenirs des développeurs concernés.
Par conséquent, plus le classement de sécurité d'un logiciel (de) dispositif médical sera bas et moins le fabricant en aura de maîtrise.
Implications pour les fabricants de dispositifs médicaux
En tant que fabricant de dispositifs médicaux, il vous est indispensable que votre logiciel (de) dispositif médical soit conforme à la réglementation applicable.
En effet, il s'agit d'une condition sine qua non pour commercialiser votre dispositif médical.
Cependant, cette condition nécessaire n'est pas forcément suffisante pour garantir la pérennité ou la revente éventuelle de votre entreprise. Il vous faut aussi asseoir son image, notamment à travers la fiabilité des dispositifs médicaux mis sur le marché.
Les exigences réglementaires applicables aux logiciels (de) dispositifs médicaux se focalisent sur la sécurité mais pas sur la fiabilité ou la maîtrise du logiciel.
Il s'agit d'un point important à prendre en considération dans le cadre de votre projet logiciel (de) dispositif médical.
Pour en savoir plus
Le projet d'évolution de la norme CEI EN 62304 prévoit d'intégrer la cybersécurité du logiciel dans le classement de sécurité des logiciels (de) dispositifs médicaux.
Bien préparer un projet logiciel (de) dispositif médical c'est aussi prévoir la documentation du logiciel dans la planification du projet.