Règlement (UE) 2021/2226 relatif aux instructions d'emploi électroniques des dispositifs médicaux
Union Européenne
Cette page reproduit le Règlement (UE) 2021/2226 relatif aux instructions d'emploi électroniques des dispositifs médicaux avec une table des matières pour vous en simplifier la consultation.
Aucune modification n'a été apportée au texte original diffusé par EUR-Lex sous licence Creative Commons Attribution 4.0 International.
Règlement d'exécution (UE) 2021/2226 de la Commission, du 14 décembre 2021, portant modalités d'application du règlement (UE) 2017/745 du Parlement européen et du Conseil en ce qui concerne les instructions d'emploi électroniques des dispositifs médicaux
LA COMMISSION EUROPÉENNE,
vu le règlement (UE) 2017/745 du Parlement européen et du Conseil du 5 avril 2017 relatif aux dispositifs médicaux, modifiant la directive 2001/83/CE, le règlement (CE) no 178/2002 et le règlement (CE) no 1223/2009 et abrogeant les directives du Conseil 90/385/CEE et 93/42/CEE, et notamment son article 5, paragraphe 6,
considérant ce qui suit:
(1) |
Pour certains dispositifs médicaux, il peut être utile de disposer d'instructions d'emploi sous forme électronique plutôt que sur support papier. Cette solution peut atténuer la pression sur l'environnement et réduire les coûts pour l'industrie des dispositifs médicaux, tout en maintenant ou en améliorant le degré de sécurité offert. |
(2) |
Le règlement (UE) no 207/2012 de la Commission a fixé les conditions selon lesquelles les instructions d'emploi des dispositifs médicaux soumis aux directives 90/385/CEE et 93/42/CEE du Conseil pourraient être fournies sous forme électronique plutôt que sur support papier. Ces deux directives du Conseil ont été abrogées et remplacées par le règlement (UE) 2017/745. Les règles en matière d'instructions d'emploi électroniques devraient par conséquent être adaptées aux nouvelles exigences du règlement (UE) 2017/745 et aux évolutions technologiques dans le domaine. |
(3) |
Il convient de réserver la possibilité de fournir les instructions d'emploi sous forme électronique plutôt que sur support papier à certains dispositifs médicaux et à leurs accessoires, destinés à être utilisés dans des conditions particulières. Pour des raisons de sécurité et d'efficacité, les utilisateurs devraient toujours être en mesure d'obtenir les instructions sur un support papier s'ils en font la demande. |
(4) |
Pour réduire les risques autant que possible, il convient que le fabricant apprécie l'opportunité de fournir les instructions sous forme électronique plutôt que sur support papier au moyen d'une évaluation des risques spécifique. |
(5) |
Pour garantir un accès inconditionnel aux instructions d'emploi électroniques et faciliter la communication des mises à jour, ces instructions d'emploi devraient être consultables sur le site web du fabricant dans une ou plusieurs langue(s) officielle(s) de l'Union définie(s) par l'État membre dans lequel le dispositif est mis à la disposition de l'utilisateur ou du patient. |
(6) |
Dans un souci de sécurité et de cohérence, les instructions d'emploi électroniques fournies en sus d'une notice d'utilisation en version papier devraient être soumises aux exigences limitées du présent règlement en ce qui concerne leur contenu et leur présentation sur le web. |
(7) |
La possibilité de fournir des instructions d'emploi au format électronique devrait être sans préjudice des obligations en matière de fourniture de cartes d'implant prévues à l'article 18 du règlement (UE) 2017/745. |
(8) |
Étant donné que la protection du droit à la vie privée des personnes physiques à l'égard du traitement des données à caractère personnel devrait être assurée à la fois par les fabricants et par les organismes notifiés, il convient de prévoir que les sites web présentant des instructions d'emploi de dispositifs médicaux respectent les exigences du règlement (UE) 2016/679 du Parlement européen et du Conseil. |
(9) |
Afin de garantir l'adaptation des règles en matière d'instructions d'emploi électroniques aux nouvelles exigences du règlement (UE) 2017/745, il convient dès lors d'abroger le règlement (UE) no 207/2012 de la Commission. Celui-ci devrait toutefois continuer de s'appliquer aux dispositifs placés sur le marché ou mis en service durant la période de transition visée à l'article 120, paragraphe 3, du règlement (UE) 2017/745. |
(10) |
Les mesures prévues par le présent règlement sont conformes à l'avis du comité «Dispositifs médicaux», |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
Le présent règlement fixe les conditions selon lesquelles les informations figurant dans la notice d'utilisation, telles que définies à l'article 2, point 14, du règlement (UE) 2017/745 et détaillées à l'annexe I, chapitre III, point 23.4., dudit règlement, peuvent être fournies par les fabricants sous un format électronique, conformément à l'annexe I, chapitre III, point 23.1. f), du règlement (UE) 2017/745.
Il établit également certaines exigences ayant trait au contenu et à la présentation sur le web des instructions d'emploi électroniques fournies en sus d'une notice d'utilisation sur support papier.
Le présent règlement ne concerne pas les produits énumérés à l'annexe XVI du règlement (UE) 2017/745.
Article 2
Aux fins du présent règlement, on entend par:
1) |
«instructions d'emploi électroniques»: les instructions d'emploi affichées sous forme électronique par le dispositif, fournies avec celui-ci par le fabricant sur un support électronique portatif ou consultables via un logiciel ou un site web; |
2) |
«utilisateurs professionnels»: les personnes qui utilisent le dispositif médical au cours de leur travail dans le cadre d'une activité professionnelle liée aux soins de santé; |
3) |
«dispositifs médicaux fixes installés»: les dispositifs médicaux et leurs accessoires qui sont conçus pour être installés, attachés ou fixés d'une façon ou d'une autre en un endroit précis d'un établissement de santé, de sorte qu'ils ne peuvent être ni démontés ni déplacés sans le recours à des outils ou à des appareils, et qui ne sont pas spécifiquement prévus pour une utilisation dans une unité de soins mobile. |
Article 3
1) Les fabricants peuvent fournir des instructions d'emploi sous forme électronique plutôt que sur support papier lorsque ces instructions ont trait à un dispositif appartenant à l'une des catégories suivantes:
a) |
les dispositifs médicaux implantables et les dispositifs médicaux implantables actifs, ainsi que leurs accessoires, visés par le règlement (UE) 2017/745; |
b) |
les dispositifs médicaux fixes installés et leurs accessoires visés par le règlement (UE) 2017/745; |
c) |
les dispositifs médicaux et leurs accessoires visés par le règlement (UE) 2017/745 qui sont pourvus d'un système intégré affichant les instructions d'emploi. |
2) Pour les dispositifs énumérés au paragraphe 1, les fabricants peuvent fournir des instructions d'emploi sous forme électronique plutôt que sur support papier, aux conditions suivantes:
a) |
les dispositifs et accessoires sont exclusivement destinés à des utilisateurs professionnels; et |
b) |
une utilisation par d'autres personnes n'est pas raisonnablement prévisible. |
3) Pour les logiciels visés par le règlement (UE) 2017/745, les fabricants peuvent fournir des instructions d'emploi sous forme électronique au moyen du logiciel lui-même plutôt que sur support papier.
Article 4
1) Les fabricants des dispositifs visés à l'article 3, paragraphes 1 et 3, qui fournissent aux utilisateurs des instructions d'emploi sous forme électronique et non sur un support papier procèdent à une évaluation des risques documentée, qui porte au moins sur les aspects suivants:
a) |
les connaissances et l'expérience des utilisateurs visés, notamment en ce qui concerne l'utilisation du dispositif, ainsi que leurs besoins; |
b) |
les caractéristiques de l'environnement dans lequel le dispositif sera utilisé; |
c) |
les connaissances et l'expérience des utilisateurs visés en ce qui concerne le matériel informatique et les logiciels nécessaires à l'affichage des instructions d'emploi électroniques; |
d) |
l'accès de l'utilisateur aux ressources électroniques raisonnablement nécessaires en cours d'utilisation; |
e) |
l'efficacité des systèmes de sécurité assurant la protection des données et des contenus électroniques contre toute modification non autorisée; |
f) |
les mécanismes de sécurité et de secours en cas de défaillance du matériel informatique ou des logiciels, en particulier quand les instructions d'emploi électroniques sont intégrées au dispositif; |
g) |
les situations d'urgence médicale prévisibles nécessitant le recours à des informations sur un support papier; |
h) |
les répercussions d'une indisponibilité temporaire du site web concerné ou de l'internet en général, ou de leur consultation depuis l'établissement de soins, et les mesures de sécurité à disposition pour remédier à cette situation; |
i) |
une évaluation du délai dans lequel la version papier des instructions d'emploi est fournie à la demande de l'utilisateur; |
j) |
une évaluation de la compatibilité du site web présentant les instructions d'emploi électroniques avec différents dispositifs susceptibles d'être utilisés pour afficher ces instructions; |
k) |
la gestion des différentes versions des instructions d'emploi, le cas échéant, conformément à l'article 5, paragraphe 8. |
2) L'évaluation des risques liés à la fourniture d'instructions d'emploi sous forme électronique est actualisée à la lumière de l'expérience acquise après la commercialisation.
Article 5
Les fabricants des dispositifs visés à l'article 3, paragraphes 1 et 3, peuvent livrer ceux-ci aux utilisateurs avec une notice d'instruction électronique plutôt que sur support papier, aux conditions suivantes:
1) |
l'évaluation des risques visée à l'article 4 démontre qu'en fournissant des instructions d'emploi électroniques, les fabricants maintiennent ou améliorent le degré de sécurité offert par la notice imprimée; |
2) |
les fabricants fournissent des instructions électroniques dans tous les États membres où le produit est disponible ou mis en service, sauf exception dûment justifiée dans l'évaluation des risques visée à l'article 4; |
3) |
ils disposent d'un système leur permettant de fournir des instructions d'emploi sur un support papier sans frais supplémentaires pour l'utilisateur, dans le délai établi dans l'évaluation des risques mentionnée à l'article 4 et au plus tard dans les sept jours civils suivant la réception de la demande de l'utilisateur, ou à la livraison du dispositif si la demande a été faite au moment de la commande; |
4) |
ils donnent des informations, à même le dispositif ou sur une notice, concernant les situations d'urgence médicale prévisibles et, pour les dispositifs munis d'un système intégré affichant les instructions, concernant la mise en marche du dispositif; |
5) |
ils assurent la qualité de la conception et du fonctionnement des instructions d'emploi électroniques et apportent la preuve des contrôles et des procédures de validation réalisés à cet effet; |
6) |
pour les dispositifs médicaux munis d'un système intégré affichant les instructions d'emploi, ils veillent à ce que l'affichage des instructions ne nuise pas à la sûreté d'utilisation du dispositif, en particulier quand celui-ci est utilisé pour surveiller ou assister le maintien en vie; |
7) |
ils fournissent, dans leur catalogue ou sur tout autre support approprié d'informations relatives au dispositif, des renseignements sur la configuration informatique nécessaire pour afficher les instructions; |
8) |
ils disposent d'un système qui indique clairement d'éventuelles mises à jour des instructions d'emploi et informe tous les utilisateurs du dispositif en cas de mise à jour nécessaire pour des raisons de sécurité; |
9) |
pour les dispositifs soumis à une date d'expiration, à l'exception des dispositifs implantables, les fabricants gardent la version électronique des instructions d'emploi à la disposition des utilisateurs pendant dix ans après la mise sur le marché du dernier dispositif et pendant au moins deux ans à compter de la date d'expiration du dernier dispositif produit; |
10) |
pour les dispositifs non soumis à une date d'expiration ainsi que pour les dispositifs implantables, ils gardent la version électronique des instructions d'emploi à la disposition des utilisateurs pendant 15 ans après la mise sur le marché du dernier dispositif; |
11) |
les instructions d'emploi sont consultables sur le site web des fabricants dans une langue officielle de l'Union définie par l'État membre dans lequel le dispositif est mis à la disposition de l'utilisateur ou du patient; |
12) |
les fabricants mettent en place des systèmes et procédures efficaces pour faire en sorte que les utilisateurs du dispositif qui ont téléchargé les instructions d'emploi sur le site web puissent être informés de toute mise à jour ou mesure corrective relative à ces instructions d'emploi; |
13) |
toutes les anciennes versions publiées des instructions d'emploi électroniques restent disponibles sur le site web. |
Article 6
1) Les fabricants indiquent clairement sur l'étiquette que les instructions d'emploi du dispositif sont fournies sous forme électronique et non sur un support papier.
Cette information figure sur l'emballage de chaque unité ou, le cas échéant, sur l'emballage de vente. Dans le cas des dispositifs médicaux fixes installés, cette information figure aussi à même le dispositif.
Dans le cas des logiciels, cette information figure à l'endroit depuis lequel le logiciel est accessible.
2) Les fabricants donnent des informations sur le mode de consultation des instructions d'emploi électroniques.
Ces informations sont fournies conformément au deuxième alinéa du paragraphe 1 ou, si cela n'est pas possible, sur un document imprimé fourni avec chaque dispositif.
3) Les informations sur le mode de consultation des instructions d'emploi électroniques comprennent également:
a) |
toute information nécessaire à l'affichage de ces instructions; |
b) |
l'IUD-ID de base et/ou l'IUD-ID propre au dispositif, tels que visés respectivement à l'article 27, paragraphe 6, et à l'article 27, paragraphe 1, point a) i), du règlement (UE) 2017/745, et toute information supplémentaire permettant l'identification de l'appareil, y compris son nom et son modèle, le cas échéant; |
c) |
les coordonnées du fabricant, à savoir son nom, son adresse, son adresse électronique ou d'autres moyens de communiquer en ligne avec lui, et son site web; |
d) |
des informations indiquant où et comment demander les instructions d'emploi sur un support papier sans frais supplémentaires, et le délai d'obtention de ces instructions, conformément à l'article 5, point 3). |
4) Quand, pour les dispositifs et accessoires visés à l'article 3, paragraphe 1, point a), une partie de la notice d'instruction est destinée au patient, cette partie n'est pas fournie sous un format électronique.
5) Les instructions d'emploi électroniques sont disponibles dans leur intégralité sous forme de texte pouvant comprendre des symboles et des graphiques, et comprennent au moins les mêmes informations que la version papier. Des fichiers vidéo ou audio peuvent être fournis en plus du texte.
Article 7
1) Quand les fabricants fournissent les instructions d'emploi avec le dispositif sur un support électronique, ou quand le dispositif lui-même est muni d'un système intégré affichant les instructions, les utilisateurs ont aussi la possibilité de consulter les instructions d'emploi électroniques sur un site web.
2) Tout site web présentant les instructions d'emploi d'un dispositif qui sont fournies au format électronique et non sur un support papier satisfait aux exigences suivantes:
a) |
les instructions sont fournies dans un format communément utilisé qui peut être lu avec un logiciel en libre accès; |
b) |
le site est protégé contre l'accès non autorisé et contre toute modification non autorisée de son contenu, conformément à l'article 4, paragraphe 1, point e); |
c) |
il fonctionne de manière à empêcher autant que possible les interruptions et les erreurs d'affichage du serveur; |
d) |
il satisfait aux exigences du règlement (UE) 2016/679; |
e) |
l'adresse internet communiquée conformément à l'article 6, paragraphe 2, est stable et directement accessible pendant les périodes fixées à l'article 5, points 9) et 10); |
f) |
toutes les anciennes versions de la notice d'instruction électronique visées à l'article 5, point 13), et leur date de publication sont présentées sur le site web. |
Article 8
Le cas échéant, la conformité aux obligations établies aux articles 4 à 7 du présent règlement est appréciée par un organisme notifié au cours de la procédure d'évaluation de la conformité visée à l'article 52 du règlement (UE) 2017/745.
Article 9
Les instructions électroniques fournies en sus d'une notice d'instruction imprimée complète sont cohérentes avec le contenu de cette dernière.
Quand elles sont fournies sur un site web, celui-ci répond aux exigences établies à l'article 7, paragraphe 2, points b), d), e) et f).
Article 10
Le règlement (UE) no 207/2012 de la Commission est abrogé.
Il continue toutefois de s'appliquer aux dispositifs placés sur le marché ou mis en service conformément à l'article 120, paragraphe 3, du règlement (UE) 2017/745, et ce jusqu'au 26 mai 2024.
Les références faites au règlement (UE) no 207/2012 s'entendent comme faites au présent règlement et sont à lire selon le tableau de correspondance figurant en annexe.
Article 11
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l'Union européenne.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
ANNEXE
Tableau de correspondance
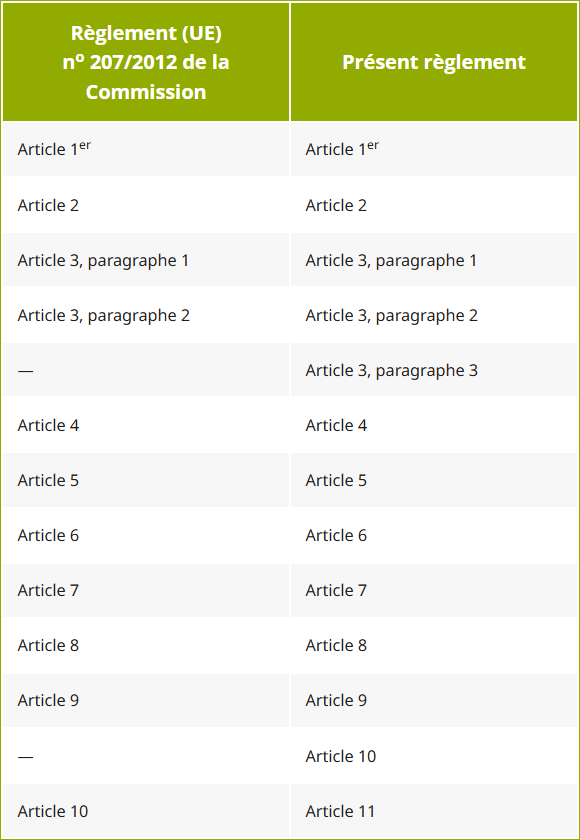
| Règlement (UE) no 207/2012 de la Commission | Présent règlement |
|---|---|
| Article 1er | Article 1er |
| Article 2 | Article 2 |
| Article 3, paragraphe 1 | Article 3, paragraphe 1 |
| Article 3, paragraphe 2 | Article 3, paragraphe 2 |
| — | Article 3, paragraphe 3 |
| Article 4 | Article 4 |
| Article 5 | Article 5 |
| Article 6 | Article 6 |
| Article 7 | Article 7 |
| Article 8 | Article 8 |
| Article 9 | Article 9 |
| — | Article 10 |
| Article 10 | Article 11 |